متابولیسم استامینوفن و مسیر آن چیست؟
استامینوفن، که در بسیاری از کشورها با نام پاراستامول نیز شناخته میشود، به عنوان یکی از رایجترین مسکنها و تببرها در قفسه داروخانههای جهان جایگاهی بیبدیل یافته است. این مولکول آلی پرکاربرد، با فرمول شیمیایی C8H9NO2، در گروه داروهای غیرمخدر و بدون نسخه (OTC) طبقهبندی میشود. نقش اصلی آن در تسکین دردهای خفیف تا متوسط، نظیر سردرد و دنداندرد، و همچنین کاهش تبهای ناشی از بیماریهای مختلف است. برخلاف داروهای ضدالتهاب غیر استروئیدی (NSAIDs) مانند ایبوپروفن، استامینوفن فاقد خواص ضدالتهابی قابل توجهی است و همین ویژگی آن را به گزینهای امنتر در برابر عوارض گوارشی و عوارض قلبی-عروقی مرتبط با NSAIDs تبدیل کرده است. با وجود این مزایا، استفاده گسترده و گاه بیرویه از آن، منجر به یک چالش بهداشتی جدی شده است؛ به طوری که مسمومیت با استامینوفن به شایعترین علت نارسایی حاد کبد در ایالات متحده و بسیاری از نقاط جهان تبدیل شده است، با دوزهایی بالاتر از ۷ گرم در بزرگسالان که پتانسیل سمی شدن را دارند.
مسیر متابولیسم استامینوفن چیست؛ جذب و دفع استامینوفن در بدن
فارماکوکینتیک استامینوفن (پاراستامول)، فرآیند جذب، توزیع، متابولیسم و دفع آن در بدن را توصیف میکند. درک این مسیر برای استفاده ایمن و مؤثر از این دارو، به ویژه در شرایط بالینی، بسیار حیاتی است.
جذب و توزیع استامینوفن در بدن
پس از مصرف خوراکی، استامینوفن با سرعتی قابل توجه و به طور کامل از طریق دستگاه گوارش جذب میشود. این جذب سریع به دلیل ماهیت مولکولی دارو است که به آن اجازه عبور سریع از غشاهای سلولی روده را میدهد. اوج غلظت پلاسمایی دارو در افراد بزرگسال سالم معمولاً بین ۳۰ تا ۶۰ دقیقه پس از مصرف به دست میآید. این زمان میتواند در حضور غذا یا در شرایطی که تخلیه معده کند است، اندکی به تأخیر بیفتد. پس از جذب، استامینوفن به طور گسترده در مایعات و بافتهای بدن، از جمله مایع مغزی-نخاعی، توزیع میشود. با این حال، اتصال آن به پروتئینهای پلاسما بسیار ناچیز است و تنها حدود ۱۰ تا ۲۵ درصد دارو به این پروتئینها متصل میشود. این ویژگی باعث میشود که بخش عمدهای از دارو به صورت آزاد در دسترس باشد تا فرآیندهای متابولیکی آغاز شود.
متابولیسم در کبد چگونه است؟
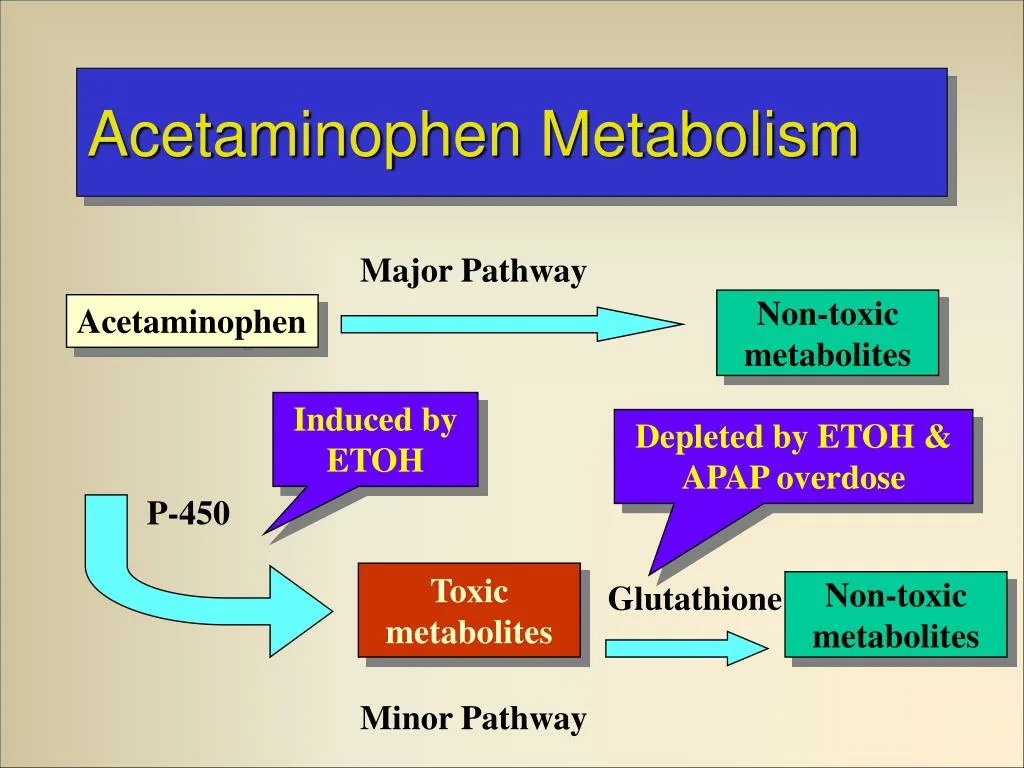
متابولیسم استامینوفن به طور عمده در کبد رخ میدهد و شامل سه مسیر اصلی است که منجر به تشکیل متابولیتهای بیاثر و محلول در آب میشوند. تقریباً ۹۰ درصد از استامینوفن از طریق دو مسیر اصلی سمزدایی میشود:
- متابولیسم از طریق گلوکورونیداسیون: این مسیر، که مهمترین و غالبترین مسیر متابولیکی در بزرگسالان است، توسط آنزیمهای UDP-گلوکورونوزیلترانسفراز (UGTs) انجام میشود. در این فرآیند، یک مولکول گلوکورونید به استامینوفن متصل میشود تا آن را به متابولیتی به نام استامینوفن-گلوکورونید تبدیل کند. این متابولیت غیرفعال، محلول در آب است و به راحتی از بدن دفع میشود.
- متابولیسم از طریق سولفاسیون: این مسیر توسط آنزیمهای سولفوترانسفراز (SULTs) کاتالیز میشود. در این واکنش، یک مولکول سولفات به استامینوفن اضافه میشود تا متابولیت دیگری به نام استامینوفن-سولفات را تشکیل دهد. این متابولیت نیز غیرفعال و محلول در آب است و به طور عمده در کودکان و نوزادان مسیر غالب متابولیسم استامینوفن به شمار میرود.
در یک مسیر فرعی، حدود ۵ تا ۱۰ درصد از استامینوفن توسط آنزیمهای سیتوکروم P450، به ویژه CYP2E1، متابولیزه میشود. محصول این مسیر یک متابولیت بسیار واکنشپذیر و سمی به نام N-استیل-پارا-بنزوکوئینون ایمین (NAPQI) است. در شرایط عادی و با دوزهای درمانی، NAPQI به سرعت و با موفقیت توسط گلوتاتیون موجود در کبد خنثی میشود و به متابولیتهای غیر سمی تبدیل میگردد. با این حال، در صورت مصرف بیش از حد دارو (مسمومیت با استامینوفن)، ذخایر گلوتاتیون کبد به سرعت depleted میشوند. در این شرایط، NAPQI تجمع یافته و به پروتئینها و لیپیدهای سلولی کبد آسیب میرساند که منجر به نکروز سلولی و نارسایی حاد کبد میشود.
فرآیند حذف استامینوفن در بدن
فرآیند حذف استامینوفن و متابولیتهای آن عمدتاً از طریق کلیهها و به وسیله ادرار صورت میگیرد. نیمهعمر حذف استامینوفن (مدت زمانی که طول میکشد تا نیمی از دارو از بدن حذف شود) در یک فرد سالم بین ۲ تا ۳ ساعت است. با این حال، در شرایطی که کبد آسیب دیده یا در موارد مسمومیت، این زمان میتواند به طور قابل توجهی افزایش یابد و به ۴ تا ۸ ساعت یا حتی بیشتر برسد. این افزایش نیمهعمر یک شاخص کلیدی برای ارزیابی شدت مسمومیت و نیاز به مداخله درمانی است. بخش عمدهای از متابولیتهای استامینوفن (بیش از ۹۰ درصد) ظرف ۲۴ ساعت پس از مصرف، از طریق ادرار از بدن دفع میشوند، که نشاندهنده کارایی بالای بدن در پردازش و حذف این دارو است.
مکانیسم عمل متابولیسم استامینوفن چگونه است؟
مکانیسم متابولیسم استامینوفن، یک معمای علمی پیچیده است که هنوز به طور کامل حل نشده است، اما پژوهشها بر تأثیر آن در سیستم عصبی مرکزی (CNS) تأکید دارند. این دارو عمدتاً با مهار سنتز پروستاگلاندینها در مغز و نخاع، که پیامرسانهای کلیدی در درک درد و تنظیم دمای بدن هستند، عمل میکند. برخلاف NSAIDs که به طور گستردهای در بافتهای محیطی نیز فعالیت دارند، استامینوفن به صورت موضعی عمل نمیکند و فاقد اثرات ضدالتهابی محیطی است. تأثیر تببر آن نیز از طریق کاهش نقطه تنظیم دما در هیپوتالاموس، مرکز کنترل دمای بدن در مغز، صورت میگیرد. همچنین، نتایج برخی مطالعات نشان میدهد که مسیر متابولیت فعال استامینوفن، موسوم به AM404، ممکن است با فعالسازی سیستم اندوکانابینوئید، به اثرات ضددرد این دارو کمک کند. این تعاملات پیچیده در سطح سلولی و عصبی، دلیل اثربخشی استامینوفن در تسکین درد و تب بدون تأثیرات جانبی ناخواسته در سیستم گوارشی را توضیح میدهد.
عوامل مؤثر بر متابولیسم استامینوفن و ریسک مسمومیت
گرچه استامینوفن دارویی ایمن و در دسترس است، اما عوامل متعددی فراتر از دوز مصرفی میتوانند بر نحوه متابولیسم آن در بدن و در نتیجه، بر خطر مسمومیت تأثیر بگذارند. درک این عوامل برای مصرف مسئولانه و پیشگیری از عوارض جدی حیاتی است.
نقش بیماریهای زمینهای در مسیر استامینوفن
یکی از مهمترین عوامل خطر، مصرف مزمن الکل است. الکل با دو مکانیسم اصلی به افزایش ریسک مسمومیت با استامینوفن منجر میشود. اولاً، الکل باعث القای آنزیم CYP2E1 در کبد میشود؛ این آنزیم مسئول تولید متابولیت سمی NAPQI است. ثانیاً، مصرف طولانیمدت الکل ذخایر گلوتاتیون در کبد را کاهش میدهد. گلوتاتیون مولکولی است که در شرایط عادی NAPQI را خنثی میکند. با کاهش گلوتاتیون، بدن توانایی خود برای سمزدایی از NAPQI را از دست میدهد و این متابولیت سمی به سلولهای کبد آسیب میرساند. به همین دلیل، به افرادی که به طور منظم الکل مصرف میکنند، توصیه میشود که دوز روزانه استامینوفن خود را به کمتر از ۲۰۰۰ میلیگرم محدود کنند.
علاوه بر الکل، بیماریهای کبدی خود یک عامل خطر مستقیم هستند. هرگونه اختلال در عملکرد کبد، مانند سیروز یا هپاتیت مزمن، توانایی کبد برای متابولیسم استامینوفن از مسیرهای ایمن (گلوکورونیداسیون و سولفاسیون) را کاهش میدهد و در مقابل، مسیر فرعی تولید NAPQI فعالتر میشود.
سوءتغذیه شدید نیز از عوامل مهم است. در افرادی که دچار کمبود پروتئین هستند، تولید گلوتاتیون کاهش مییابد و این امر به طور غیرمستقیم خطر سمیت کبدی را افزایش میدهد. همینطور، نارسایی کلیوی میتواند فرآیند دفع متابولیتهای غیرسمی استامینوفن را کند کرده و تجمع آنها را در بدن در پی داشته باشد.
تداخلات دارویی و عوارض جانبی خاص
تداخلات دارویی نیز میتوانند فرآیند متابولیسم استامینوفن را تحت تأثیر قرار دهند. داروهایی که به عنوان القا کنندههای آنزیمهای کبدی شناخته میشوند (مانند فنیتوئین، کاربامازپین و ریفامپین) میتوانند تولید متابولیت سمی NAPQI را افزایش دهند، زیرا این داروها فعالیت آنزیمهای مسئول تولید این متابولیت را تقویت میکنند.
علاوه بر این، یک نگرانی خاص در مورد تداخل استامینوفن با وارفارین، یک داروی رقیقکننده خون، وجود دارد. مطالعات موردی و تحقیقات بالینی نشان دادهاند که مصرف منظم و طولانیمدت استامینوفن، حتی در دوزهای درمانی، میتواند با افزایش شاخص INR (شاخص استاندارد برای اندازهگیری زمان لخته شدن خون)، خطر خونریزی را در بیماران تحت درمان با وارفارین بالا ببرد. بنابراین، نظارت دقیق بر INR در این بیماران ضروری است.
در نهایت، درک این عوامل خطر به متخصصان و بیماران کمک میکند تا با احتیاط بیشتری از استامینوفن استفاده کنند و در صورت وجود شرایط زمینهای یا مصرف داروهای دیگر، دوز مصرفی را تعدیل کرده و از بروز عوارض جانبی خطرناک جلوگیری نمایند.
کاربردها و اثربخشی بالینی متابولیسم استامینوفن در بدن
استامینوفن، به عنوان یک گزینه درمانی همهکاره، اثربخشی بالایی در طیف گستردهای از شرایط بالینی از خود نشان داده است. بر اساس گزارش سازمان بهداشت جهانی (WHO)، این دارو در ۸۵ درصد از موارد، برای کاهش تب و دردهای خفیف تا متوسط موفقیتآمیز است. این دارو به عنوان خط اول درمان برای دردهای عضلانی و مفصلی، سردردهای تنشی، دنداندرد و دردهای قاعدگی توصیه میشود. همچنین، استامینوفن به عنوان یک داروی تببر موثر برای مدیریت تب ناشی از عفونتهای ویروسی مانند آنفلوآنزا و کووید-۱۹ به کار میرود. یک مطالعه منتشر شده توسط کالج متخصصان زنان و زایمان آمریکا (ACOG) تأکید کرد که استامینوفن در دوزهای توصیهشده، ایمنترین مسکن برای استفاده در دوران بارداری و شیردهی است، هرچند مصرف درازمدت آن نیازمند احتیاط و مشورت با پزشک است.
متابولیسم کبدی استامینوفن
کبد به عنوان اصلیترین مرکز متابولیسم در بدن، نقش محوری و تعیینکنندهای در پردازش و حذف استامینوفن ایفا میکند. فرآیند پیچیده متابولیسم این دارو در کبد، شامل مسیرهای متعددی است که تعادل میان آنها، سرنوشت دارو و سلامت کبد را مشخص میکند. درک این مسیرها برای مصرف ایمن استامینوفن کاملاً ضروری است.
مسیرهای غالب و ایمن متابولیسم کبدی استامینوفن
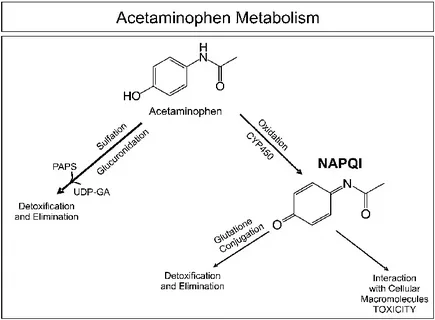
بخش عمدهای از استامینوفن (بیش از ۹۰ درصد) از طریق دو مسیر ایمن و غالب، که به عنوان مسیرهای کونژوگاسیون (conjugation) شناخته میشوند، متابولیزه میگردد. این مسیرها، دارو را به مولکولهای محلول در آب تبدیل میکنند که به راحتی از بدن دفع میشوند:
- گلوکورونیداسیون (Glucuronidation): این مسیر که سهمی بین ۵۵ تا ۶۰ درصد از متابولیسم استامینوفن را به خود اختصاص میدهد، اصلیترین راه دفع دارو در بزرگسالان است. در این فرآیند، آنزیمهای UDP-گلوکورونوزیلترانسفراز (UGTs)، یک مولکول گلوکورونیک اسید را به استامینوفن متصل میکنند. حاصل این واکنش، یک متابولیت غیرفعال و غیرسمی به نام استامینوفن-گلوکورونید است که از طریق ادرار از بدن خارج میشود. این مسیر کارایی بسیار بالایی دارد و تا زمانی که دوز دارو در محدوده درمانی باشد، بخش عمدهای از آن را پردازش میکند.
- سولفاتاسیون (Sulfation): این مسیر، سهمی حدود ۳۰ تا ۳۵ درصد از متابولیسم استامینوفن را بر عهده دارد و به ویژه در کودکان و نوزادان، نقشی برجستهتر ایفا میکند. در این فرآیند، آنزیمهای سولفوترانسفراز (SULTs) یک گروه سولفات را به مولکول استامینوفن اضافه میکنند و آن را به متابولیتی غیرفعال به نام استامینوفن-سولفات تبدیل میکنند. همانند مسیر گلوکورونیداسیون، این متابولیت نیز بیخطر است و به آسانی از طریق ادرار دفع میگردد.
مسیر فرعی متابولیسم کبدی استامینوفن
در کنار مسیرهای ایمن، بخش کوچکی از استامینوفن (تقریباً ۵ تا ۱۰ درصد) از طریق یک مسیر فرعی و بالقوه خطرناک متابولیزه میشود. این فرآیند توسط سیستم آنزیمی سیتوکروم P450، به ویژه ایزوآنزیم CYP2E1، کاتالیز میگردد. محصول این واکنش اکسیداسیون، یک متابولیت بسیار واکنشپذیر و سمی به نام N-استیل-پارا-بنزوکوئینون ایمین (NAPQI) است.
در شرایط مصرف عادی و با دوزهای درمانی، NAPQI بلافاصله توسط آنتیاکسیدان قدرتمند بدن، یعنی گلوتاتیون، خنثی میشود. گلوتاتیون به NAPQI متصل شده و آن را به متابولیتهای غیرسمی تبدیل میکند که از طریق ادرار دفع میشوند. این مکانیزم، سیستم حفاظتی طبیعی بدن در برابر سمیت استامینوفن است.
نقش اشباع و دپلیشن در مسمومیت کبدی استامینوفن
نقطه عطف در مسمومیت با استامینوفن، زمانی رخ میدهد که تعادل میان این مسیرها به هم میخورد. با مصرف بیش از حد دارو (اوردوز)، ظرفیت مسیرهای اصلی کونژوگاسیون (گلوکورونیداسیون و سولفاتاسیون) به سرعت اشباع میشود. در نتیجه، بخش بیشتری از استامینوفن به سمت مسیر فرعی CYP2E1 هدایت میشود که منجر به تولید ناگهانی و شدید NAPQI میگردد. همزمان با این افزایش تولید، ذخایر گلوتاتیون موجود در کبد نیز به سرعت مصرف و به پایان میرسد (depleted).
این عدم تعادل، به تجمع بیرویه NAPQI منجر میشود. وقتی گلوتاتیون کافی برای خنثیسازی وجود نداشته باشد، NAPQI به پروتئینهای حیاتی و لیپیدهای سلولهای کبدی متصل شده و به آنها آسیب میرساند. این آسیب در نهایت باعث نکروز سلولی (مرگ سلولی) و در موارد شدید، نارسایی حاد کبد میگردد که میتواند کشنده باشد. به همین دلیل، در شرایط اوردوز، مداخله سریع پزشکی برای بازگرداندن سطح گلوتاتیون (با استفاده از پادزهر ان-استیلسیستئین) حیاتی است.
مسمومیت با استامینوفن
مسمومیت با استامینوفن یک فوریت پزشکی جدی است که به دلیل مصرف دوزهای بالاتر از حد مجاز رخ میدهد. این وضعیت، زنجیرهای از حوادث را آغاز میکند که از اشباع مسیرهای متابولیکی ایمن شروع شده و به افزایش شدید تولید NAPQI و تخلیه گلوتاتیون میانجامد. علائم بالینی مسمومیت به چهار فاز مجزا تقسیم میشود: فاز اول (۰.۵ تا ۲۴ ساعت پس از مصرف) با علائم عمومی مانند تهوع، استفراغ و بیحالی؛ فاز دوم (۱۸ تا ۷۲ ساعت) با درد در ناحیه کبد در سمت راست بالای شکم؛ فاز سوم (۷۲ تا ۹۶ ساعت) که اوج آسیب کبدی با علائمی مانند زردی، اختلالات انعقادی و در موارد شدید، کومای کبدی و نارسایی چندعضوی را شامل میشود؛ و فاز چهارم که دوره بهبودی در بیمارانی است که زنده میمانند. مهمترین اقدام درمانی، تجویز پادزهر N-استیلسیستئین (NAC) است که با بازسازی ذخایر گلوتاتیون و غیرفعال کردن NAPQI، از آسیب بیشتر به کبد جلوگیری میکند. نتایج مطالعات بالینی نشان میدهد که تجویز NAC در ۸ تا ۱۲ ساعت اولیه پس از اوردوز، بیش از ۹۵ درصد در پیشگیری از آسیب کبدی مؤثر است. پزشکان از نمودار تخصصی Rumack-Matthew Nomogram برای ارزیابی ریسک مسمومیت بر اساس غلظت دارو در خون و زمان مصرف استفاده میکنند.
اشکال دارویی استامینوفن و نحوه مصرف
استامینوفن در فرمهای مختلفی در دسترس است که انتخاب هر کدام به شرایط بیمار بستگی دارد. قرصهای خوراکی رایجترین شکل دارویی هستند و معمولاً در دوزهای ۳۲۵، ۵۰۰ و ۶۵۰ میلیگرم عرضه میشوند. شربت و قطره به دلیل دوزهای قابل تنظیم بر اساس وزن، برای کودکان و افرادی که در بلع قرص مشکل دارند، مناسبتر هستند. در مواردی که بیمار دچار استفراغ شدید است یا قادر به مصرف خوراکی نیست، شیافهای استامینوفن به عنوان جایگزین مؤثر عمل میکنند. یک مطالعه موردی نشان داد که جذب دارو از طریق مقعد در مقایسه با مسیر خوراکی، متابولیسم اولیه کمتری در کبد دارد. برای دردهای شدید و در محیط بیمارستانی، آمپول استامینوفن (۱۰۰۰ میلیگرم) با تزریق وریدی، سریعترین اثر را با شروع در عرض ۵ تا ۱۰ دقیقه ارائه میدهد. حداکثر دوز روزانه برای بزرگسالان سالم ۴۰۰۰ میلیگرم تعیین شده است، در حالی که برای کودکان، این مقدار بر اساس وزن (۱۰ تا ۱۵ میلیگرم به ازای هر کیلوگرم) محاسبه میشود.
مقایسه استامینوفن با سایر داروها
برای درک بهتر جایگاه استامینوفن، مقایسه آن با سایر مسکنها ضروری است. ایبوپروفن، به عنوان یک NSAID، در کاهش التهاب ناشی از بیماریهایی مانند آرتریت موثرتر عمل میکند، اما در مقابل، خطر عوارض گوارشی و قلبی-عروقی بیشتری دارد. این تفاوت در مکانیسم عمل، استامینوفن را به گزینهای امنتر برای بیمارانی با سابقه زخم معده یا مشکلات کلیوی تبدیل کرده است. در موارد دردهای شدیدتر، استامینوفن به تنهایی کافی نیست و اغلب در ترکیب با یک داروی مخدر مانند کدئین استفاده میشود (استامینوفن کدئین). یک مطالعه منتشر شده توسط سازمان غذا و داروی ایران نشان داد که مصرف استامینوفن کدئین به دلیل پتانسیل اعتیاد و وابستگی، کاهش یافته است. داروهای دیگری مانند آسپرین و ناپروکسن نیز در دسته NSAIDها قرار میگیرند و به دلیل پروفایل عوارض متفاوت، در شرایط خاصی تجویز میشوند. انتخاب مسکن مناسب همواره باید با توجه به وضعیت بالینی بیمار، شدت درد و تداخلات دارویی احتمالی، و تحت نظر پزشک انجام گیرد.
پایش و نظارت پزشکی بر متابولیسم استامینوفن
با توجه به خطرات بالقوه استامینوفن، پایش و نظارت پزشکی، به ویژه در موارد مسمومیت، از اهمیت بالایی برخوردار است. در صورت اوردوز، آزمایشهای خون برای اندازهگیری سطح استامینوفن (APAP)، آنزیمهای کبدی (ALT و AST)، بیلیروبین و INR (شاخص انعقادی) به صورت فوری انجام میشود. نتایج یک مطالعه منتشر شده در سال ۲۰۲۳ بر روی مسمومیتهای حاد استامینوفن نشان داد که بیماران با آسیب کبدی، غلظت بالاتری از متابولیتهای سمی NAPQI و درصد پایینتری از متابولیتهای سولفاتاسیون در خون خود داشتند، که این یافته میتواند به شناسایی زودهنگام بیماران پرخطر کمک کند. تیم درمانی، شامل پزشک، پرستار و داروساز، باید بر رعایت دقیق دوز مصرفی تأکید کرده و بیماران را از خطرات مصرف همزمان چندین داروی حاوی استامینوفن آگاه سازند. این رویکرد چندتخصصی و هماهنگ، نقش مهمی در پیشگیری و مدیریت بهینه مسمومیتهای دارویی ایفا میکند.
متابولیسم استامینوفن در گروههای جمعیتی خاص و تفاوتهای فردی
متابولیسم استامینوفن در همه افراد یکسان نیست و میتواند تحت تأثیر عوامل فردی و جمعیتی قرار گیرد. در کودکان و نوزادان، فرآیندهای متابولیکی به طور کامل تکامل نیافتهاند، و به همین دلیل دوز دارو باید با دقت بسیار بالا و بر اساس وزن محاسبه شود. نوزادان به ویژه ظرفیت سولفاتاسیون بالاتری دارند که آنها را در برابر مسمومیت در دوزهای بالا آسیبپذیر میسازد. در افراد مسن، کاهش عملکرد کبد و کلیه میتواند منجر به طولانی شدن نیمهعمر دارو و افزایش ریسک سمیت شود، که نیازمند کاهش دوز است. علاوه بر این، مطالعات ژنتیکی نشان دادهاند که تفاوتهای فردی در ژنهای مرتبط با آنزیمهای متابولیزهکننده دارو (مانند UGT و CYP) میتوانند بر سرعت متابولیسم و حساسیت به سمیت استامینوفن تأثیر بگذارند. به عنوان مثال، برخی واریانتهای ژنی در جمعیتهای آسیایی یا آفریقاییتبار ممکن است منجر به پروفایلهای متابولیکی متفاوتی شوند که درک آنها برای پزشکی شخصیسازیشده آینده ضروری است. این یافتهها بر اهمیت دریافت مشاوره تخصصی از پزشک یا داروساز پیش از مصرف هرگونه دارو تأکید میکنند.